我们的孤儿药认定服务
科特咨询为您提供一系列业内顶尖的药政事务服务,帮助您顺利完成FDA和EMA的孤儿药注册申报流程,帮助您的孤儿药产品高效快速地上市。
我们的流程
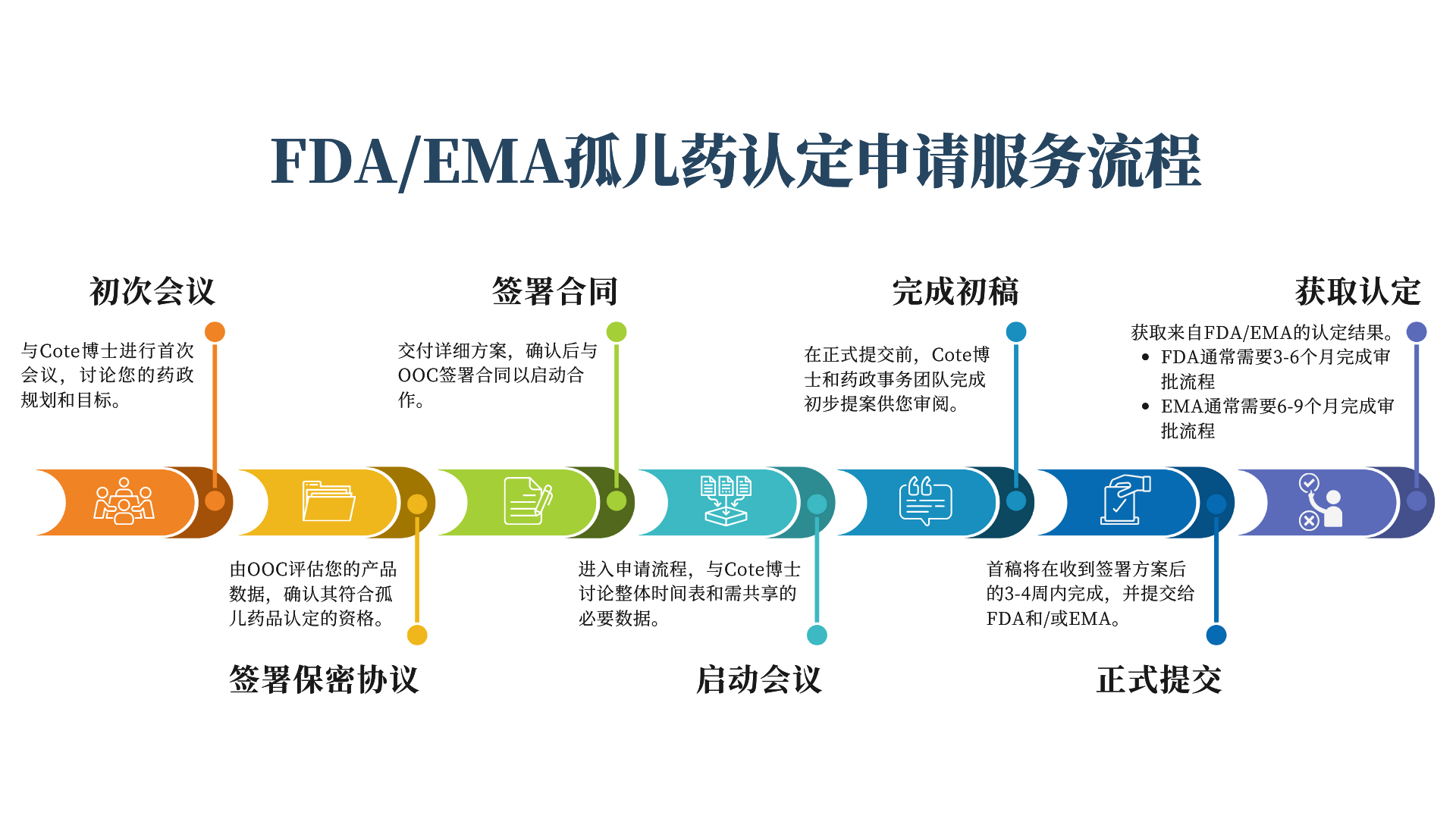
孤儿药认定
我们的旗舰项目。我们为罕见病药品撰写FDA和EMA孤儿药认定(ODD)申请。获得ODD可以享有多重经济效益,有助于药品更早更快地上市,是孤儿药注册申报的首要环节。
注册申报规划
无论您处于孤儿药开发过程中的哪个阶段,我们都可以评估您的项目并制定合理的监管策略,以帮助加快实现您的目标,确保您充分利用所有可用的监管优惠政策。
-597w.jpg)

与FDA的会议
(INTERACT、Pre-IND、Type A、B、C、D)
从INTERACT会议到Pre-NDA/-BLA会议,您需要与FDA进行频繁接触,了解他们对您药物开发的看法。我们负责申请及优化这些会议,让您充分利用FDA为药物开发者提供的资源,以获取最有效的开发建议。
IND申报
在进行首次人体试验之前,您必须向FDA提交新药试验申请,证明人体使用您的药物是安全的。在Pre-IND会议获取过FDA的建议后,我们将校阅、分析并撰写您的IND申请,最大程度规避临床试验延迟或暂停 (Clinical Hold) 的风险。


各项加速程序的申请
- 突破性疗法认定
- 快速通道指定
- 加速批准
- 优先审评券
FDA的各项加速程序旨在加速某些符合要求的药物的开发流程。突破性治疗、快速通道和优先审评都需要相关认定才能获得加速激励。科特咨询可以帮助您撰写和提交这些认定申请。加速批准允许申请方获取替代性终点(surrogate endpoint)。我们会协助您准备会议,以便获得使用替代性终点的批准。
其他服务
- 特定传染病项目 (QIDP) 认定
- 505(b)(2)
对我们的服务感兴趣吗?我们来帮助您!
如果您对我们的服务感兴趣,欢迎您联系我们告知您的需求,我们将竭尽全力为您服务。


由FDA孤儿产品开发办公室前主任科特博士带领的科特咨询是一家专注于罕见病领域的药政事务咨询公司。从早期数据评估到药品上市,科特咨询为孤儿药提供全方位全流程的注册申报支持,帮助药企在欧美市场获得各项认定和批准。
版权所有 | 科特咨询有限责任公司
技术支持:知了网络


 公众号
公众号
 咨询顾问
咨询顾问